Os péptidos son unha clase de compostos formados pola conexión de múltiples aminoácidos mediante enlaces peptídicos.Son omnipresentes nos organismos vivos.Ata agora, atopáronse decenas de miles de péptidos en organismos vivos.Os péptidos xogan un papel importante na regulación das actividades funcionais de varios sistemas, órganos, tecidos e células e nas actividades da vida, e úsanse a miúdo na análise funcional, investigación de anticorpos, desenvolvemento de fármacos e outros campos.Co desenvolvemento da biotecnoloxía e da tecnoloxía de síntese de péptidos, cada vez máis fármacos peptídicos foron desenvolvidos e aplicados na clínica.
Hai unha gran variedade de modificacións peptídicas, que se poden dividir simplemente en modificación posterior e modificación do proceso (usando modificación de aminoácidos derivados) e modificación N-terminal, modificación C-terminal, modificación da cadea lateral, modificación de aminoácidos, modificación do esqueleto, etc., dependendo do lugar de modificación (Figura 1).Como un medio importante para cambiar a estrutura da cadea principal ou os grupos de cadeas laterales das cadeas peptídicas, a modificación do péptido pode cambiar eficazmente as propiedades físicas e químicas dos compostos peptídicos, aumentar a solubilidade en auga, prolongar o tempo de acción in vivo, cambiar a súa distribución biolóxica, eliminar a inmunoxenicidade. , reducir os efectos secundarios tóxicos, etc. Neste traballo preséntanse varias estratexias importantes de modificación de péptidos e as súas características.
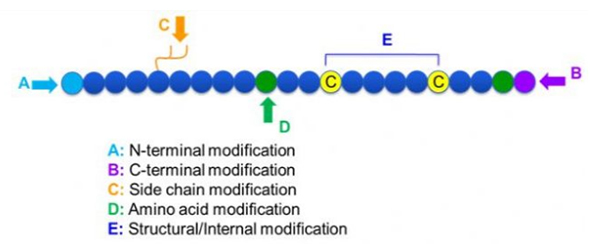
1. Ciclización
Os péptidos cíclicos teñen moitas aplicacións en biomedicina, e moitos péptidos naturais con actividade biolóxica son péptidos cíclicos.Debido a que os péptidos cíclicos tenden a ser máis ríxidos que os lineais, son extremadamente resistentes ao sistema dixestivo, poden sobrevivir no tracto dixestivo e presentan unha maior afinidade polos receptores diana.A ciclización é a forma máis directa de sintetizar péptidos cíclicos, especialmente para os péptidos con gran esqueleto estrutural.Segundo o modo de ciclización, pódese dividir en tipo de cadea lateral de cadea lateral, tipo de terminal - tipo de cadea lateral, terminal - tipo de terminal (tipo de extremo a extremo).
(1) cadea lateral a cadea lateral
O tipo máis común de ciclización de cadea lateral a cadea lateral é a ponte disulfuro entre os residuos de cisteína.Esta ciclización introdúcese mediante a desprotección dun par de residuos de cisteína e despois oxidados para formar enlaces disulfuro.A síntese policíclica pódese conseguir mediante a eliminación selectiva de grupos de protección sulfhidrilo.A ciclación pódese facer nun disolvente post-disociación ou nunha resina de pre-disociación.A ciclación nas resinas pode ser menos efectiva que a ciclación con disolventes porque os péptidos das resinas non forman facilmente conformacións ciclificadas.Outro tipo de ciclización da cadea lateral - cadea lateral é a formación dunha estrutura amida entre un ácido aspártico ou un residuo de ácido glutámico e o aminoácido base, o que require que o grupo de protección da cadea lateral poida ser eliminado selectivamente do polipéptido. sobre a resina ou despois da disociación.O terceiro tipo de ciclización da cadea lateral é a formación de éteres difenílicos por tirosina ou p-hidroxifenilglicina.Este tipo de ciclización en produtos naturais só se atopa nos produtos microbianos, e os produtos de ciclización adoitan ter un valor medicinal potencial.A preparación destes compostos require condicións de reacción únicas, polo que non se usan a miúdo na síntese de péptidos convencionais.
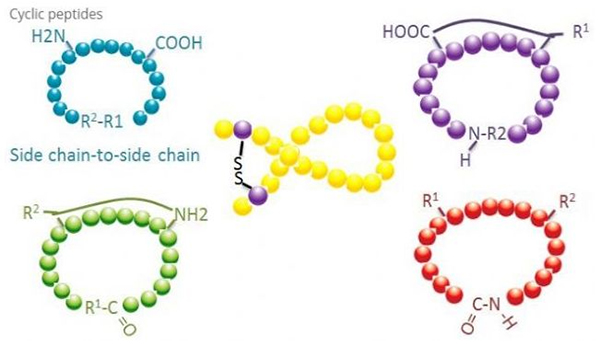
(2) terminal a cadea lateral
A ciclación da cadea lateral terminal implica normalmente o extremo C-terminal co grupo amino da cadea lateral lisina ou ornitina, ou o extremo N coa cadea lateral de ácido aspártico ou glutámico.Outra ciclación polipeptídica realízase formando enlaces éter entre C terminal e as cadeas laterais de serina ou treonina.
(3) Tipo terminal ou cabeza a cola
Os polipéptidos de cadea poden ser ciclados nun disolvente ou fixados nunha resina mediante ciclación da cadea lateral.Deben usarse baixas concentracións de péptidos na centralización de disolventes para evitar a oligomerización dos péptidos.O rendemento dun polipéptido de anel sintético de cabeza a cola depende da secuencia do polipéptido da cadea.Polo tanto, antes de preparar péptidos cíclicos a gran escala, primeiro debe crearse unha biblioteca de posibles péptidos de chumbo encadeados, seguido da ciclización para atopar a secuencia cos mellores resultados.
2. N-metilación
A N-metilación ocorre orixinalmente nos péptidos naturais e introdúcese na síntese de péptidos para evitar a formación de enlaces de hidróxeno, facendo así os péptidos máis resistentes á biodegradación e á eliminación.A síntese de péptidos utilizando derivados de aminoácidos N-metilados é o método máis importante.Ademais, tamén se pode usar a reacción de Mitsunobu de intermedios polipéptidos-resinas de N-(2-nitrobenceno sulfonilo cloruro) con metanol.Este método utilizouse para preparar bibliotecas de péptidos cíclicos que conteñen aminoácidos N-metilados.
3. Fosforilación
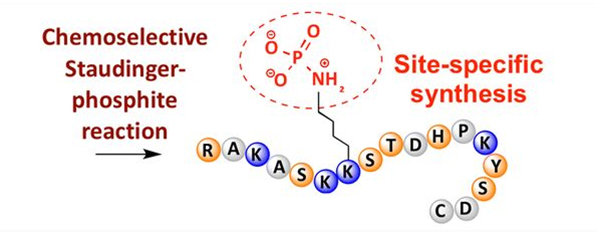
A fosforilación é unha das modificacións postraducionais máis comúns na natureza.Nas células humanas, máis do 30% das proteínas están fosforiladas.A fosforilación, especialmente a fosforilación reversible, xoga un papel importante no control de moitos procesos celulares, como a transdución de sinais, a expresión xénica, a regulación do ciclo celular e do citoesqueleto e a apoptose.
A fosforilación pódese observar nunha variedade de residuos de aminoácidos, pero os obxectivos de fosforilación máis comúns son os residuos de serina, treonina e tirosina.Os derivados de fosfotirosina, fosfotreonina e fosfoserina poden introducirse nos péptidos durante a síntese ou formarse despois da síntese peptídica.A fosforilación selectiva pódese conseguir utilizando residuos de serina, treonina e tirosina que eliminan selectivamente os grupos protectores.Algúns reactivos de fosforilación tamén poden introducir grupos de ácido fosfórico no polipéptido mediante a modificación posterior.Nos últimos anos, a fosforilación específica do sitio da lisina conseguiuse mediante unha reacción químicamente selectiva de Staudinger-fosfito (Figura 3).
4. Miristoilación e palmitoilación
A acilación do N-terminal con ácidos graxos permite que os péptidos ou proteínas se unan ás membranas celulares.A secuencia miridamoilada no N-terminal permite que as proteínas quinases da familia Src e as proteínas Gaq da transcriptase inversa sexan dirixidas para unirse ás membranas celulares.O ácido mirístico ligouse ao N-terminal da resina-polipéptido mediante reaccións de acoplamento estándar, e o lipopéptido resultante puido disociarse en condicións estándar e purificarse mediante RP-HPLC.
5. Glicosilación
Os glicopéptidos como a vancomicina e a teicolanina son antibióticos importantes para o tratamento de infeccións bacterianas resistentes aos medicamentos, e outros glicopéptidos adoitan utilizarse para estimular o sistema inmunitario.Ademais, dado que moitos antíxenos microbianos están glicosilados, é de gran importancia estudar os glicopéptidos para mellorar o efecto terapéutico da infección.Por outra banda, comprobouse que as proteínas da membrana celular das células tumorais presentan unha glicosilación anormal, o que fai que os glicopéptidos teñan un papel importante na investigación do cancro e da defensa inmune dos tumores.Os glicopéptidos prepáranse polo método Fmoc/t-Bu.Os residuos glicosilados, como a treonina e a serina, adoitan introducirse nos polipéptidos mediante fMOC activados por éster de pentafluorofenol para protexer os aminoácidos glicosilados.
6. Isopreno
A isopentadienilación ocorre nos residuos de cisteína da cadea lateral preto do C-terminal.O isopreno proteico pode mellorar a afinidade da membrana celular e formar interacción proteína-proteína.As proteínas isopentadienadas inclúen a tirosina fosfatase, a pequena GTase, as moléculas de cochaperona, a lámina nuclear e as proteínas de unión centromérica.Os polipéptidos de isopreno pódense preparar utilizando isopreno sobre resinas ou introducindo derivados de cisteína.
7. Modificación do polietilenglicol (PEG).
A modificación do PEG pódese usar para mellorar a estabilidade hidrolítica das proteínas, a biodistribución e a solubilidade do péptido.A introdución de cadeas PEG nos péptidos pode mellorar as súas propiedades farmacolóxicas e tamén inhibir a hidrólise dos péptidos por encimas proteolíticas.Os péptidos PEG atravesan a sección transversal capilar glomerular con máis facilidade que os péptidos ordinarios, reducindo moito a eliminación renal.Debido á vida media activa prolongada dos péptidos PEG in vivo, o nivel de tratamento normal pódese manter con doses máis baixas e fármacos peptídicos menos frecuentes.Non obstante, a modificación do PEG tamén ten efectos negativos.Grandes cantidades de PEG evitan que o encima degrade o péptido e tamén reducen a unión do péptido ao receptor diana.Pero a baixa afinidade dos péptidos PEG adoita compensarse pola súa vida media farmacocinética máis longa, e ao estar presentes máis tempo no corpo, os péptidos PEG teñen unha maior probabilidade de ser absorbidos nos tecidos diana.Polo tanto, as especificacións do polímero PEG deben optimizarse para obter resultados óptimos.Por outra banda, os péptidos PEG acumúlanse no fígado debido á redución do aclaramento renal, o que orixina síndrome macromolecular.Polo tanto, as modificacións do PEG deben deseñarse con máis coidado cando se usan péptidos para probas de drogas.
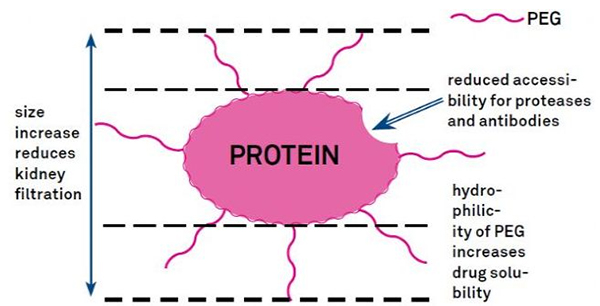
Os grupos de modificación comúns de modificadores de PEG pódense resumir aproximadamente do seguinte xeito: Amino (-amina) -NH2, aminometil-Ch2-NH2, hidroxi-OH, carboxi-Cooh, sulfhidrilo (-Tiol) -SH, Maleimida -MAL, carbonato de succinimida - SC, acetato de succinimida -SCM, propionato de succinimida -SPA, n-hidroxisuccinimida -NHS, acrilato-ch2ch2cooh, aldehído -CHO (como propional-ald, butyrALD), base acrílica (-acrilato-acrl), azido-azida, biotinilo - Biotina, fluoresceína, glutaril -GA, acrilato hidrrazido, alquino-alquino, p-toluenosulfonato -OTs, succinimida succinato -SS, etc. Os derivados de PEG con ácidos carboxílicos pódense acoplar a aminas n-terminais ou cadeas laterais de lisina.O PEG activado por amino pode acoplarse a cadeas laterais de ácido aspártico ou glutámico.PEG mal-activado pódese conxugar a mercaptano de cadeas laterais de cisteína totalmente desprotexidas [11].Os modificadores de PEG clasifícanse normalmente do seguinte xeito (nota: mPEG é metoxi-PEG, CH3O-(CH2CH2O)n-CH2CH2-OH):
(1) modificador PEG de cadea recta
mPEG-SC, mPEG-SCM, mPEG-SPA, mPEG-OTs, mPEG-SH, mPEG-ALD, mPEG-butyrALD, mPEG-SS
(2) modificador PEG bifuncional
HCOO-PEG-COOH, NH2-PEG-NH2, OH-PEG-COOH, OH-PEG-NH2, HCl·NH2-PEG-COOH, MAL-PEG-NHS
(3) modificador PEG ramificado
(mPEG)2-NHS, (mPEG)2-ALD, (mPEG)2-NH2, (mPEG)2-MAL
8. Biotinización
A biotina pode unirse fortemente coa avidina ou a estreptavidina, e a forza de unión está ata próxima ao enlace covalente.Os péptidos marcados con biotina úsanse habitualmente en inmunoensaios, histocitoquímica e citometría de fluxo baseada en fluorescencia.Tamén se poden usar anticorpos antibiotina marcados para unir péptidos biotinilados.As etiquetas de biotina adoitan estar unidas á cadea lateral da lisina ou á terminal N.O ácido 6-aminocaproico úsase a miúdo como enlace entre os péptidos e a biotina.A unión é flexible ao unirse ao substrato e únese mellor en presenza de obstáculos estéricos.
9. Etiquetado fluorescente
O marcado fluorescente pódese usar para rastrexar polipéptidos en células vivas e estudar encimas e mecanismos de acción.O triptófano (Trp) é fluorescente, polo que se pode usar para o etiquetado intrínseco.O espectro de emisión do triptófano depende do medio periférico e diminúe coa diminución da polaridade do disolvente, unha propiedade útil para detectar a estrutura peptídica e a unión ao receptor.A fluorescencia do triptófano pódese apagar mediante ácido aspártico protonado e ácido glutámico, o que pode limitar o seu uso.O grupo cloruro de Dansyl (Dansyl) é altamente fluorescente cando se une a un grupo amino e úsase a miúdo como etiqueta fluorescente para aminoácidos ou proteínas.
Resonancia de fluorescencia A conversión de enerxía (FRET) é útil para estudos enzimáticos.Cando se aplica FRET, o polipéptido de substrato adoita conter un grupo marcador de fluorescencia e un grupo de extinción da fluorescencia.Os grupos fluorescentes marcados son extinguidos polo extintor mediante transferencia de enerxía non fotónica.Cando o péptido se disocia do encima en cuestión, o grupo marcador emite fluorescencia.
10. Polipéptidos en gaiola
Os péptidos en gaiola teñen grupos protectores ópticamente removibles que protexen o péptido da unión ao receptor.Cando se expón á radiación UV, o péptido actívase, restaurando a súa afinidade co receptor.Debido a que esta activación óptica pode controlarse segundo o tempo, a amplitude ou a localización, os péptidos en gaiola pódense usar para estudar as reaccións que ocorren nas células.Os grupos protectores máis utilizados para polipéptidos en gaiola son os grupos 2-nitrobencilo e os seus derivados, que poden introducirse na síntese de péptidos mediante derivados protectores de aminoácidos.Os derivados de aminoácidos que se desenvolveron son a lisina, a cisteína, a serina e a tirosina.Non obstante, os derivados de aspartato e glutamato non se usan habitualmente debido á súa susceptibilidade á ciclación durante a síntese e disociación de péptidos.
11. Péptido poliantigénico (MAP)
Os péptidos curtos normalmente non son inmunes e deben acoplarse a proteínas portadoras para producir anticorpos.O péptido poliantixénico (MAP) está composto por varios péptidos idénticos conectados a núcleos de lisina, que poden expresar especificamente inmunóxenos de alta potencia e poden usarse para preparar coplas de proteína portadora de péptido.Os polipéptidos MAP pódense sintetizar mediante síntese en fase sólida sobre resina MAP.Non obstante, o acoplamento incompleto produce cadeas peptídicas ausentes ou truncadas nalgunhas ramas e, polo tanto, non presenta as propiedades do polipéptido MAP orixinal.Como alternativa, os péptidos pódense preparar e purificar por separado e despois acoplarse a MAP.A secuencia peptídica unida ao núcleo peptídico está ben definida e caracterízase facilmente mediante espectrometría de masas.
Conclusión
A modificación de péptidos é un medio importante para deseñar péptidos.Os péptidos modificados químicamente non só poden manter unha alta actividade biolóxica, senón que tamén evitan eficazmente os inconvenientes da inmunoxenicidade e da toxicidade.Ao mesmo tempo, a modificación química pode dotar aos péptidos dunhas novas excelentes propiedades.Nos últimos anos, o método de activación de CH para a posmodificación de polipéptidos desenvolveuse rapidamente e conseguíronse moitos resultados importantes.
Hora de publicación: 20-mar-2023
