Segundo a forma de conexión de aminoácidos e azucre, o péptido de azucre pódese dividir en catro categorías: glicosilación O, glicosilación C a N, sacarificación do orballo e conexión GPI (glicofosfatidlyinositol).
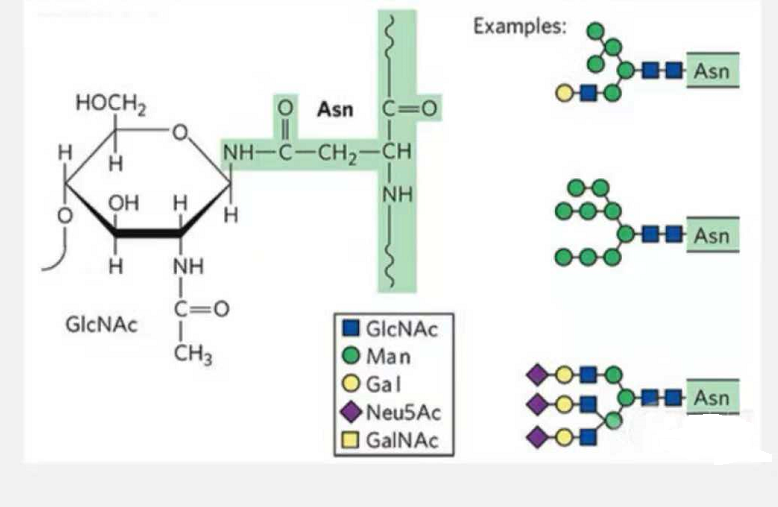
1. Os glicopéptidos de N-glicosilación están compostos por N-acetamida glicosa no extremo redutor da cadea de glicanos (Glc-Nac) unida ao átomo de N no grupo amida da cadea lateral dalgún Asn da cadea peptídica, e ao Asn. capaz de enlazar a cadea de glicanos debe situarse no AsN-X-Ser /Thr (X! =P) no motivo formado polos residuos.O azucre é N-acetilglucosamina.
Glicopéptido estrutural modificado por N-glicosilación
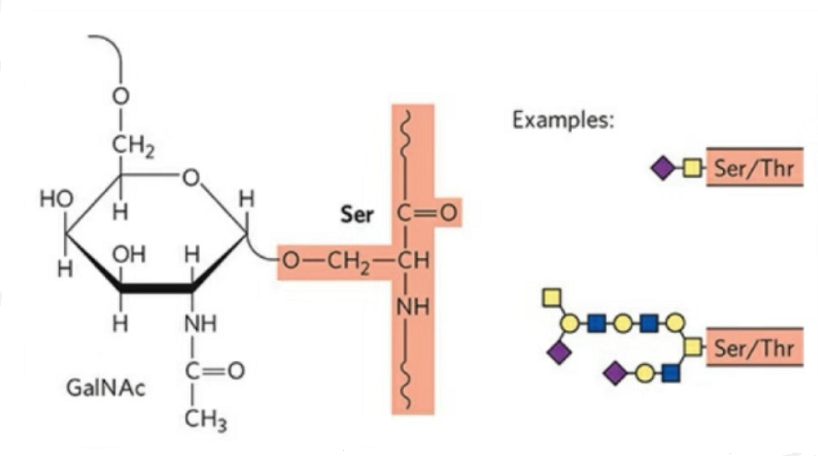
2. A estrutura da O-glicosilación é máis sinxela que a N-glicosilación.Este glicopéptido é xeralmente máis curto que o glicano, pero ten máis tipos que a N-glicosilación.Ser e Thr poden estar glicosilados xeralmente na cadea peptídica.Ademais, hai glicopéptidos decorados con glicosilación de tirosina, hidroxilo e hidroxiprolina.A posición do enlace é o átomo de osíxeno hidroxilo na cadea lateral do residuo.Os azucres ligados son galactosa ou N-acetilgalactosamina (Gal&GalNAc) ou glicosa/glucosamina (Glc/GlcNAc), manosa/manosamina (Man/ManNAc), etc.
A O-glicosilación modifica a estrutura
3. Glicosilación do glicopéptido O-GlcNAC ((N-acetilcisteína (NAC)) (glcnAcN-acetilglucosamina/acetilglucosamina)
Unha única glicosilación de N-acetilglucosamina (GlcNAc) conecta as proteínas O-GlcNAc co átomo de osíxeno hidroxilo do residuo serina ou treonina dunha proteína.A glicosilación de O-GlcNA é un adorno monosacárido de O-GlcNAc sen extensión de glicano;Do mesmo xeito que a fosforilación de péptidos, a glicosilación de O-GlcNAc dos glicopéptidos tamén é un proceso dinámico de decoración de proteínas.A decoración anormal de O-GlcNAc pode causar unha variedade de enfermidades como diabetes, enfermidades cardiovasculares, tumores, enfermidade de Alzheimer, etc.
Puntos de glicosilación dos glicopéptidos
As estruturas básicas das cadeas polipeptídicas e de azucre están unidas ás cadeas de proteínas mediante enlaces covalentes, e os sitios que unen as cadeas de azucre chámanse sitios de glicosilación.Dado que non existe un modelo para seguir a biosíntese das cadeas de azucres de glicopéptidos, uniranse diferentes cadeas de azucre ao mesmo sitio de glicosilación, dando lugar á chamada deshomoxeneidade microscópica.
Glicosilación de glicopéptidos
1. Efecto da glicosilación de glicopéptidos sobre a eficacia da terapia das proteínas terapéuticas
No caso das proteínas terapéuticas, a glicosilación tamén afecta á vida media e á orientación dos fármacos proteicos in vivo.
2. Glicosilación de glicopéptidos solubles e proteínas
Os estudos demostraron que as cadeas de azucre na superficie das proteínas poden mellorar a solubilidade molecular das proteínas
3. Glicosilación de glicopéptidos e inmunoxenicidade das proteínas
Por unha banda, as cadeas de azucre na superficie das proteínas poden inducir respostas inmunitarias específicas.Por outra banda, as cadeas de azucre poden cubrir certas superficies da superficie das proteínas e reducir a súa inmunoxenicidade
4. Glicosilación de glicopéptidos que aumenta a estabilidade das proteínas
A glicosilación pode aumentar a estabilidade das proteínas a varias condicións de desnaturalización (como desnaturalizantes, calor, etc.) e evitar a agregación de proteínas.Ao mesmo tempo, as cadeas de azucre na superficie das proteínas tamén poden cubrir algúns puntos de degradación proteolítica das moléculas de proteínas, aumentando así a resistencia das proteínas ás proteinases.
5. Glicosilación de glicopéptidos que afecta á actividade biolóxica das moléculas proteicas
O cambio da glicosilación de proteínas tamén pode permitir que as moléculas de proteína formen novas actividades biolóxicas
Hora de publicación: 03-ago-2023