Transferencia de enerxía por resonancia de fluorescencia (FRET)
A transferencia de enerxía de resonancia de fluorescencia (FRET) é un proceso de transferencia de enerxía non radiativa no que a enerxía do estado excitado do doador transfírese ao estado excitado do aceptor mediante a interacción de parellas eléctricas intermoleculares.Este proceso non implica fotóns e, polo tanto, non é radiativo.Este ensaio ten as vantaxes de ser rápido, sensible e sinxelo.
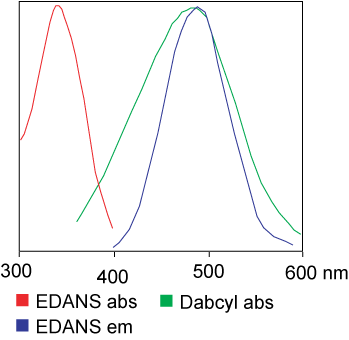
O colorante usado no ensaio FRET pode ser idéntico.Pero na maioría das aplicacións utilízanse realmente diferentes colorantes.En resumo, a transferencia de enerxía de resonancia luminosa é a transferencia dun par de dipolos do doador (colorante 1) ao aceptor (colorante 2) cando o grupo doador está excitado.En xeral, o espectro de emisión do grupo do fluoróforo doador se solapa co espectro de absorción do grupo do aceptor."Cando a distancia entre os dous fluoróforos é adecuada (10 - 100 A), pódese observar a transferencia de enerxía do fluoróforo do doador ao aceptor".O método de transferencia de enerxía depende da estrutura química do receptor:
1. Convértese en vibración molecular, é dicir, a luz luminosa da transferencia de enerxía desaparece.(O receptor é un extintor de luz)
2. A emisión é máis intensa que o propio receptor, o que provoca un desprazamento ao vermello no espectro de fluorescencia secundaria.(Os receptores son emisores luminosos).
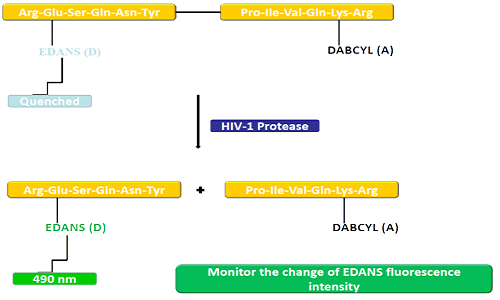
O grupo doador (EDANS) e o xene aceptor (DABCYL) están ligados uniformemente ao substrato natural da protease do VIH, e cando o substrato non está desconectado, DABCYL pode apagar EDANS e volverse indetectable para o flúor.Tras a desconexión da protease do VIH-1, o EDANS xa non é extinguido por DABCYL e as luciferases EDANS poden detectarse posteriormente.A dispoñibilidade de inhibidores da protease pódese controlar mediante cambios na intensidade de fluorescencia dos EDANS.
Os péptidos FRET son ferramentas convenientes para estudar a inespecificidade da peptidase.Dado que o seu proceso de reacción pódese controlar continuamente, proporciona un método conveniente para detectar a actividade enzimática.O brillo producido despois da hidrólise dos enlaces peptídicos polo doador/aceptor proporciona unha medida da actividade enzimática a concentracións nanomolares.Cando o péptido FRET está intacto, mostra unha súbita desaparición do flash interno, pero cando se rompe calquera enlace peptídico oposto ao doador/aceptor, libera un flash, que se pode detectar de forma continua e entón pódese cuantificar a actividade enzimática.
Hora de publicación: 14-Ago-2023